Einleitung: Warum zwei internationale Normen dasselbe Ziel verfolgen
Stellen Sie sich vor: Ein Umweltlabor misst die Temperatur einer Wasserprobe bei exakt 23,4 °C. Zeitgleich bestimmt ein medizinisches Labor die Körpertemperatur eines Patienten – ebenfalls bei 23,4 °C (hypothetisch, für den Vergleich). Zwei völlig unterschiedliche Kontexte, zwei verschiedene Normen – und doch dieselbe Anforderung: Das Ergebnis muss absolut verlässlich sein.
Moderne Laboratorien – ob Prüf-, Kalibrier- oder medizinische Einrichtungen – stehen vor denselben Herausforderungen: verlässliche Ergebnisse, eindeutige Rückverfolgbarkeit, auditkonforme Dokumentation und ein robustes Qualitätsmanagement. Zwar unterscheiden sich ihre Aufgaben fundamental, dennoch beruhen ISO 17025 (Prüf- und Kalibrierlaboratorien) und ISO 15189 (medizinische Laboratorien) auf identischen Grundprinzipien: Kompetenz, Validität, Rückverfolgbarkeit, Transparenz und kontinuierliche Verbesserung.
Beide Normen haben das gleiche übergeordnete Ziel: Ergebnisse erzeugen, auf die sich Patient:innen, Kund:innen und Aufsichtsbehörden verlassen können. Dieser Artikel zeigt, wo beide Normen sich treffen, wo sie divergieren – und wie moderne Digitalisierung beide Welten vereint.

ISO 17025 vs. ISO 15189 – Anwendungsbereiche und Zielgruppen
ISO 17025 / DIN EN ISO/IEC 17025
Gilt für: Prüf- und Kalibrierlaboratorien
Fokus: technische Kompetenz, Messunsicherheit, Prüfmittelmanagement
Typische Bereiche: Umweltanalytik, Materialprüfung, physikalische und chemische Messungen
Die Norm legt starke Betonung auf:
- Rückverfolgbarkeit nach SI-Einheiten (§ 6.5 / § 6.6)
- Anforderungen an Prüfmittel und Equipment (§ 6.4 Equipment)
- Validität und Wiederholbarkeit von Ergebnissen
Praxisbeispiel: Ein Kalibrierlabor für Industriewaagen muss nachweisen können, dass jede Gewichtsmessung auf das internationale Kilogramm-Normal zurückführbar ist – mit dokumentierter Kalibrierkette über nationale Messinstitute bis zur SI-Einheit.
ISO 15189 / DIN EN ISO 15189
Gilt für: medizinische Labore
Fokus: Patientenversorgung, Befundvalidierung, prä- & postanalytische Prozesse
Bezieht ISO 9001-Elemente stärker ein
Neben technischer Kompetenz liegt ein besonderer Schwerpunkt auf:
- klinischer Verantwortung
- Ergebnisinterpretation
- Qualität der Patientenversorgung
Praxisbeispiel: Ein klinisches Labor misst den HbA1c-Wert eines Diabetikers. Hier geht es nicht nur um die technische Präzision der Messung, sondern auch um die korrekte Interpretation im klinischen Kontext – wurde die Probe korrekt entnommen? Ist der Befund für die Therapieentscheidung aussagekräftig? Wurde der Patient richtig vorbereitet?
Gemeinsame Qualitätsprinzipien
Trotz unterschiedlicher Zielgruppen basieren beide Normen auf identischen Fundamenten. Diese Gemeinsamkeiten sind kein Zufall – sie spiegeln universelle Qualitätsanforderungen wider, die für jede Form präziser Messung gelten.
1. Kompetenz des Personals
ISO 17025 § 6.2: Qualifikation für Prüf- und Kalibrieraufgaben
ISO 15189 § 7.2 / § 5.1: Fachliche Kompetenz für medizinische Befundung
Beide verlangen dokumentierte Kompetenzen, Schulungen und regelmäßige Wirksamkeitsüberprüfungen.
In der Praxis bedeutet das: Ein Labortechniker, der ein Massenspektrometer bedient, muss seine Qualifikation ebenso nachweisen wie ein MTA, der Blutbilder erstellt. Beide müssen regelmäßig geschult werden, beide durchlaufen Kompetenzprüfungen – und beide hinterlassen ihre Unterschrift in elektronischen Systemen, die genau dokumentieren, wer wann welche Messung durchgeführt hat.
2. Rückverfolgbarkeit (Traceability) – Der Kern beider Normen
Rückverfolgbarkeit bedeutet, dass jedes Ergebnis eindeutig auf eine gültige Referenz – idealerweise SI-Einheiten – zurückgeführt werden kann. Dies ist das absolute Fundament beider Normen.
ISO 17025 § 6.5 / § 6.6: Rückführung auf nationale oder internationale Normale
ISO 15189 § 7.3.3: Rückverfolgbarkeit klinischer Messgrößen
Warum ist das so kritisch? Stellen Sie sich vor, zwei Labore messen dieselbe Probe – und kommen zu unterschiedlichen Ergebnissen. Ohne Rückverfolgbarkeit auf gemeinsame Standards ist nicht erkennbar, welches Labor richtig liegt. Bei einer Materialprüfung könnte das zu Produktionsfehlern führen. Bei einer medizinischen Diagnose könnte ein Menschenleben davon abhängen.
Konkretes Beispiel: Ein Thermometer wird beim nationalen Messinstitut kalibriert. Dieses Institut wiederum führt seine Messungen auf das internationale Kelvin-Normal zurück. Jede Temperaturmessung in Ihrem Labor kann nun über diese Kette bis zur SI-Basiseinheit nachverfolgt werden – mit dokumentierter Messunsicherheit auf jeder Stufe.
3. Dokumentation & Datenintegrität
Beide Normen betonen die Notwendigkeit auditfähiger Daten. Vier Prinzipien stehen im Mittelpunkt:
- Integrität: Daten dürfen nicht unbemerkt verändert werden
- Vollständigkeit: Keine Lücken in der Dokumentation
- Schutz vor Manipulation: Änderungen müssen nachvollziehbar sein
- Audit-Trail: Wer hat wann was geändert – und warum?
Realitätscheck: Ein Auditor erscheint in Ihrem Labor und fragt: "Zeigen Sie mir die Kalibrierhistorie des HPLC-Systems vom März 2023." Können Sie innerhalb von 5 Minuten einen lückenlosen Nachweis vorstellen? Beide Normen fordern genau das – und moderne digitale Systeme machen es möglich.
4. Qualitätsmanagement
Beide Normen schreiben ein vollständiges QM-System vor:
- Dokumentenlenkung
- Korrekturmaßnahmen (CAPA)
- kontinuierliche Verbesserung
- Risikomanagement
Der Unterschied zum "Papier-QM" vergangener Tage: Früher bedeutete das Ordner voller Protokolle, die niemand las. Heute bedeutet es intelligente Workflows, die automatisch eskalieren, wenn ein Gerät überfällig zur Kalibrierung ist – bevor es zu Messfehlen kommt.
Zentrale Unterschiede im Überblick
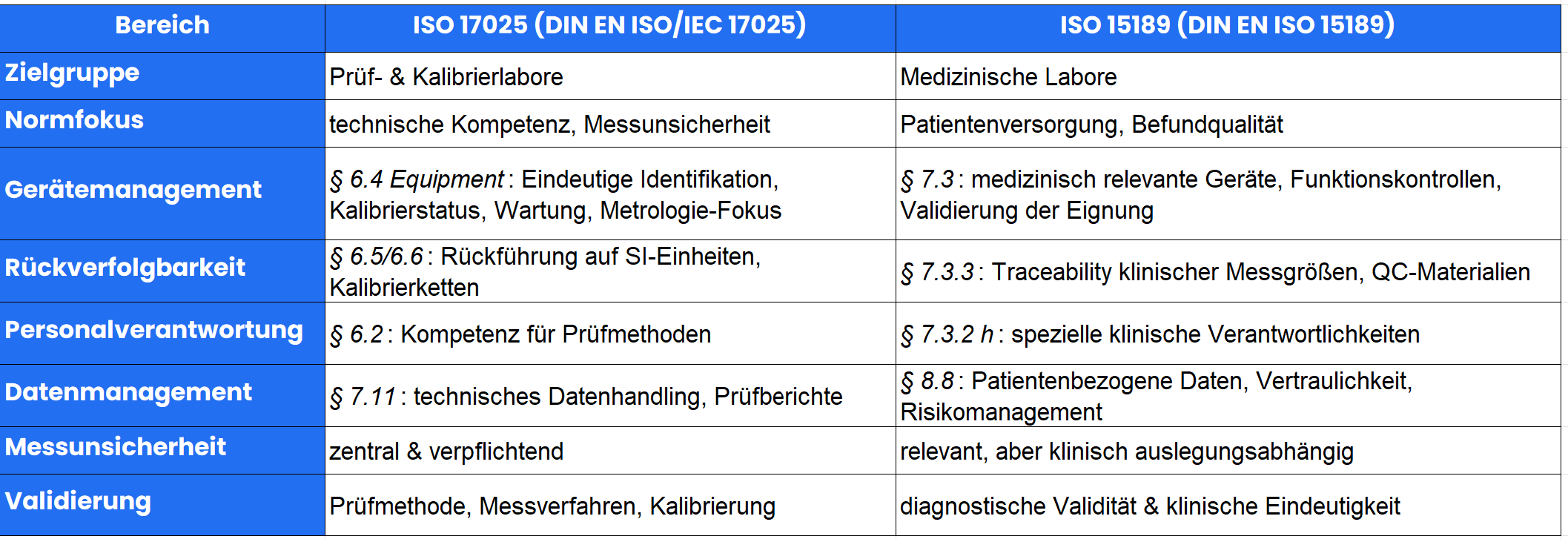
Was beide Normen wirklich verbindet – die 6 Qualitätssäulen
Unabhängig vom Laborauftrag verfolgen beide Normen dieselben Qualitätsziele:
- Reproduzierbare Ergebnisse – Messungen müssen wiederholbar sein
- Eindeutige Rückverfolgbarkeit aller Messungen auf anerkannte Standards
- Sicheres Gerätemanagement – von der Inbetriebnahme bis zur Stilllegung
- Auditkonforme Dokumentation – jederzeit auditbereit
- Risiko- und Fehlerreduktion durch präventive Kontrollen
- Eindeutige Verantwortlichkeiten – keine Messung ohne klare Zuständigkeit
Damit sind ISO 17025 und ISO 15189 viel näher beieinander, als es auf den ersten Blick wirkt. Sie sind zwei Dialekte derselben Qualitätssprache.
Gerätemanagement als gemeinsamer Schlüssel
Geräte sind die Grundlage jeder analytischen Messung. Ein falsch kalibriertes Pipettier-System, ein überfälliges Thermometer, ein Analysegerät ohne Wartungshistorie – all das kann Ergebnisse verfälschen. Beide Normen definieren daher klare Anforderungen:
1. Eindeutige Kennzeichnung
Jedes Gerät muss eindeutig identifizierbar sein:
- Asset-ID (z.B. "HPLC-001")
- Kalibrierstatus (aktuell gültig, überfällig, gesperrt)
- Standort (Labor A, Raum 3.14)
- Verantwortliche Person (Dr. Müller)
ISO 17025 § 6.4.2 verlangt eine eindeutige Identifikation sämtlicher Prüfmittel.
ISO 15189 § 7.3.2 fordert eine vollständige Geräteakte.
Praxisszenario: Ein Auditor betritt Ihr Labor, zeigt auf ein HPLC-System und fragt: "Wann wurde dieses Gerät zuletzt kalibriert? Wer hat es durchgeführt? Welche Abweichungen gab es?" Mit digitaler Kennzeichnung (z.B. QR-Code) scannen Sie das Gerät, und alle Informationen erscheinen auf dem Tablet – in Sekunden.
2. Kalibrierung und Rückführbarkeit
Jede Messung muss nachvollziehbar auf SI-Einheiten zurückzuführen sein – sei es Masse, Zeit, Temperatur oder Volumen.
Die 7 SI-Basiseinheiten:
- Meter (m) – Länge
- Kilogramm (kg) – Masse
- Sekunde (s) – Zeit
- Kelvin (K) – Temperatur
- Mol (mol) – Stoffmenge
- Ampere (A) – elektrische Stromstärke
- Candela (cd) – Lichtstärke
Beispiel aus der Praxis: Ein Pharmaunternehmen prüft das Volumen von Injektionsfläschchen. Die verwendete Pipette wurde mit einem kalibrierten Referenzvolumen geprüft. Dieses Referenzvolumen wiederum wurde bei einem akkreditierten Kalibrierlabor zertifiziert, das seine Messung auf nationale Normale zurückführt. Die gesamte Kette ist dokumentiert – vom Fläschchen bis zur SI-Einheit "Liter".
3. Wartung und Funktionskontrollen
Beide Normen verlangen dokumentierte:
- Wartungsintervalle (z.B. jährlich, halbjährlich)
- Kalibrierzyklen (basierend auf Herstellervorgaben oder Risikobewertung)
- Funktionsprüfungen (tägliche Checks, z.B. Temperaturverifikation)
- Abweichungsmanagement (Was passiert bei Fehlermeldungen?)
- Sperrstatus bei Fehlfunktionen (defekte Geräte dürfen nicht verwendet werden)
Realfall: Ein Inkubator zeigt plötzlich 38 °C statt 37 °C. Ohne System würde das vielleicht unbemerkt bleiben. Mit digitalem Gerätemanagement löst die Abweichung einen Alarm aus, das Gerät wird automatisch gesperrt, und alle seit der letzten erfolgreichen Kontrolle durchgeführten Messungen werden zur Überprüfung markiert.
4. Gerätehistorie & Audit-Trail
Damit Auditor:innen und QA-Verantwortliche jede Aktion nachvollziehen können:
- Was wurde geändert? (Kalibrierzertifikat hochgeladen)
- Wann? (15.03.2025, 14:32 Uhr)
- Von wem? (Dr. Schmidt)
- Mit welcher Begründung? (Jahreskalibierung gemäß Wartungsplan)
Der Unterschied zwischen Papier und Digital: In einem Papierlogbuch können Einträge nachträglich geändert werden – und niemand merkt es. Ein digitaler Audit-Trail ist unveränderbar: Jede Änderung wird mit Zeitstempel und Benutzer-ID protokolliert. Das schafft Vertrauen – gegenüber Auditoren, Kunden und Behörden.
Digitalisierung als Bindeglied – wie moderne Laborsoftware beide Normen vereint
Die Anforderungen von ISO 17025 und ISO 15189 mögen auf dem Papier komplex wirken. In der Praxis scheitern viele Labore nicht am Verständnis der Normen, sondern an ihrer effizienten Umsetzung. Hier kommt die Digitalisierung ins Spiel.
Die Herausforderung des "Papier-Labors"
Stellen Sie sich ein Labor vor, das noch mit Excel-Tabellen, Papierlogbüchern und manuellen Erinnerungen arbeitet:
- Ein Gerät ist überfällig zur Kalibrierung – aber niemand hat es bemerkt, weil die Excel-Liste nicht aktualisiert wurde.
- Ein Auditor fragt nach der Wartungshistorie – und das Team durchsucht drei Ordner, um die relevanten Seiten zusammenzusuchen.
- Eine Messung muss rückverfolgt werden – aber die Charge des verwendeten Referenzmaterials wurde nicht notiert.
Das ist keine Unfähigkeit – das ist der Alltag in vielen Laboren, die noch nicht digitalisiert haben. Und genau hier setzt moderne Laborsoftware an.
Kernthemen, die Laborsoftware abdecken muss
1. Digitales Prüfmittelmanagement
- Zentrale Geräteakten mit allen relevanten Informationen (Handbücher, Zertifikate, Serviceberichte)
- Automatische Kalibrier- & Wartungserinnerungen, bevor Fristen ablaufen
- Rückverfolgbarkeit aller Aktivitäten durch Audit-Trail
- Nutzung von SI-Einheiten zur Kalibrierung mit dokumentierter Messabweichung
2. Validierte Dokumentenlenkung
- Elektronische Logbücher, die automatisch Zeitstempel und Benutzer erfassen
- Versionskontrolle für SOPs und Arbeitsanweisungen
- Automatisierte Berichte für Audits und Managementreviews
3. Integration mit Laborprozessen
- Verknüpfung von Geräten mit konkreten Messungen: Welches Gerät wurde für welche Probe verwendet?
- Automatische Plausibilitätsprüfungen: Wurde das Gerät vor der Messung kalibriert?
- Echtzeit-Dashboards: Welche Geräte sind überfällig? Wo besteht Handlungsbedarf?
Warum eine integrierte Lösung den Unterschied macht
Viele Labore arbeiten mit mehreren isolierten Systemen: Eine Software für Gerätemanagement, eine andere für Dokumentenlenkung, Excel für Kalibrierfristen. Das Ergebnis: Datensilos, doppelte Eingaben, Fehlerquellen.
Eine integrierte Lösung hingegen verbindet alle Prozesse:
Beispiel-Workflow in einem digitalisierten Labor:
- Ein neues HPLC-System wird angeliefert
- Es wird in der Software registriert (Asset-ID, Standort, Verantwortlicher)
- Der Wartungsplan wird automatisch erstellt (Kalibrierung alle 12 Monate, Funktionsprüfung täglich)
- Das System sendet 30 Tage vor Fristablauf eine Erinnerung
- Die Kalibrierung wird durchgeführt und das Zertifikat digital hochgeladen
- Das Gerät ist automatisch wieder freigegeben – und alle nachfolgenden Messungen werden damit verknüpft
- Bei einem Audit kann die gesamte Historie mit einem Klick exportiert werden
Das ist keine Zukunftsvision – das ist in digitalisierten Laboren bereits Realität.
LabThunder: Eine Plattform für beide Normenwelten
Digitale Lösungen wie LabThunder zeigen, wie die Anforderungen von ISO 17025 und ISO 15189 nicht nur erfüllt, sondern effizient und fehlerfrei umgesetzt werden können. Das System wurde speziell für Laborumgebungen entwickelt und verbindet:
- Digitales Prüfmittelmanagement – zentrale Verwaltung aller Geräte, Werkzeuge und Messmittel
- Vollständige Gerätehistorien – von der Inbetriebnahme bis zur Stilllegung
- Kalibriertracking – automatische Erinnerungen, Fristenverwaltung, Zertifikats-Upload
- Digitale Logbücher – elektronische Aufzeichnungen mit Audit-Trail
- Rückverfolgbarkeit aller Aktivitäten – wer hat wann was gemacht?
- Rollenbasiertes Berechtigungsmanagement – nicht jeder darf alles ändern
- Auditkonformität für GxP-, ISO- und medizinische Normen
Damit bildet LabThunder alle zentralen Anforderungen beider Normen ab – von der eindeutigen Identifikation über Wartungen bis zu vollständig auditfähigen Prozessketten. Ob Umweltlabor oder Klinik: Die Qualitätsprinzipien bleiben dieselben, und die Software passt sich dem jeweiligen Kontext an.
Fazit: Zwei Normen, ein Ziel – Qualität, Kompetenz und Nachvollziehbarkeit
Auch wenn ISO 17025 und ISO 15189 unterschiedliche Laborwelten adressieren, verfolgen sie dasselbe Ziel: verlässliche Ergebnisse auf Basis kompetenter, rückverfolgbarer und auditkonformer Prozesse.
Beide Normen bauen auf denselben Säulen:
- Messkompetenz – nur qualifiziertes Personal führt Messungen durch
- Rückverfolgbarkeit – jedes Ergebnis ist auf anerkannte Standards zurückführbar
- Robustes Gerätemanagement – Geräte werden kalibriert, gewartet und überwacht
- Qualitätsgesicherte Prozesse – dokumentiert, validiert, auditkonform
Die eigentliche Frage ist nicht, ob Ihr Labor diese Anforderungen erfüllen muss – sondern wie effizient Sie sie erfüllen. Papierlogbücher und Excel-Listen sind nicht falsch – aber sie sind fehleranfällig, zeitaufwändig und schwer zu auditieren.
Durch konsequente Digitalisierung – insbesondere mittels integrierter Softwarelösungen – lassen sich diese Anforderungen nicht nur erfüllen, sondern effizient und revisionssicher umsetzen. Labore, die diesen Schritt gehen, gewinnen nicht nur Zeit und Sicherheit – sie schaffen die Grundlage für exzellente Qualität, auf die sich Patient:innen, Kund:innen und Aufsichtsbehörden verlassen können.
Denn am Ende zählt nur eines: das richtige Ergebnis, zur richtigen Zeit, mit lückenloser Nachvollziehbarkeit.

FAQ – ISO 17025 vs. ISO 15189
Was ist der wichtigste Unterschied zwischen ISO 17025 und ISO 15189?
ISO 17025 richtet sich an Prüf- und Kalibrierlaboratorien und fokussiert auf messtechnische Kompetenz, Messunsicherheit und technische Validität.ISO 15189 richtet sich an medizinische Laboratorien und legt zusätzlich starken Wert auf Patientenversorgung, Prä-/Postanalytik und klinische Bewertung.Beide Normen basieren jedoch auf denselben Qualitätsprinzipien.
Benötigen medizinische Labore eine ISO 17025-Zertifizierung?
Nein. Für medizinische Labore ist ISO 15189 die einschlägige Norm.
ISO 17025 wird nur dann relevant, wenn ein medizinisches Labor eigene Kalibrierungen oder metrologische Prüfungen durchführt, die nachweislich rückführbar sein müssen.
Was bedeutet Rückverfolgbarkeit in beiden Normen?
Rückverfolgbarkeit bedeutet, dass jede Messung auf ein anerkanntes Referenznormal zurückgeführt werden kann – idealerweise auf SI-Einheiten (z. B. kg, K, s, mol).
- ISO 17025 § 6.5 / 6.6: vollständige Kalibriernachweise
- ISO 15189 § 7.3.3: klinisch relevante Traceability, QC-Materialien
Verlangen beide Normen ein dokumentiertes Gerätemanagement?
Ja. Beide fordern eindeutige Identifikation, Kalibrier- und Wartungspläne, Funktionskontrollen sowie eine revisionssichere Historie.
- ISO 17025: § 6.4 Equipment
- ISO 15189: § 7.3
Digitale Geräteakten erleichtern die Auditfähigkeit erheblich.
Muss Messunsicherheit in beiden Normen berechnet werden?
- ISO 17025: Ja, zwingend. Messunsicherheit ist eine Kernforderung.
- ISO 15189: Ja, aber kontextabhängig. Sie muss für klinisch relevante Parameter bewertet werden, ist jedoch weniger formal strukturiert.
Welche Rolle spielt die elektronische Dokumentation?
Beide Normen verlangen ein System, das:
- nachvollziehbar ist,
- manipulationssicher,
- versioniert,
- auditfähig,
- und revisionssicher.
Elektronische Logbücher und validierte Laborsoftware erfüllen diese Anforderungen zuverlässiger als Papierakten.
Sind Audit-Trails in beiden Normen vorgeschrieben?
Indirekt ja.
Während die Normen das Wort „Audit-Trail“ nicht zwingend verwenden, setzen die Anforderungen an Datenintegrität, Rückverfolgbarkeit und Änderungsverfolgung ein solches System faktisch voraus.
Warum sind SI-Einheiten so wichtig?
SI-Einheiten (Kilogramm, Meter, Sekunde, Kelvin usw.) bilden die gemeinsame Sprache aller Messungen.
Nur über SI-rückführbare Kalibrierungen entsteht echte internationale Vergleichbarkeit und auditfähige Rückverfolgbarkeit – unerlässlich in beiden Normen.


LabThunder:
✅ Compliant nach ISO 17025, GMP/GLP und ISO 15189
✅ Digitale Logbücher statt Zettelchaos
✅ Thunder AI - zentrale Intelligenz bei Fehlern & Fragen
✅ Smarte & Predictive Maintenance verhindert Ausfälle
✅ Mehr Unabhängigkeit von externem Service
✅ bis zu 50 % weniger Serviceeinsätze
✅ easy to use - keine IT nötig
Kontaktieren Sie uns noch heute für einen kostenfreie Demo:




%20new.png)















.jpg)
.jpg)

